“
背景简述
2021年是“十四五”的开局之年,科技与产业的变革加速,科技创新模式也出现了新的发展方向与特征。在医疗器械方面,国家通过立法来治理行业并推动该产业往创新、高质量方向发展。本文将重点回顾过去一年里,与医疗器械相关的重要政策。
我国医疗器械行业从大力推动发展到标准趋严,相关政策的发展共经历了三个阶段。
01
《医疗器械监督管理条例》
2021 年 6 月 1 日,经国务院修订后的《医疗器械监督管理条例》开始正式实施。修订后的《条例》主要包括四个方向:
一是增加了许多新制度、新机制、新方式。落实了医疗器械注册人、备案人制度,完善监管制度,建立职业化专业化检查员制度,着力提升治理水平。
二是简化优化了审评审批程序,着力提高监管效能,鼓励行业创新发展。将医疗器械创新纳入发展重点,优化审批、备案程序,对临床试验实行默示许可,缩短审查期限,实行告知性备案。
三是细化完善了医疗器械全生命周期质量安全的责任。规定注册人、备案人应当建立并有效运行质量管理体系,加强产品上市后管理,建立并执行产品追溯和召回制度,对医疗器械研制、生产、经营、使用全过程中的安全性、有效性依法承担责任。
四是加大惩处力度,提高违法成本。落实“处罚到人”要求,加大对违法单位的行业和市场禁入处罚力度,大幅提高罚款幅度。确立了医疗器械监督管理遵循风险管理、全程管控、科学监管、社会共治的总原则,为新时代医疗器械监管工作提出了总的要求、指明了总的方向。
与 17 年修订的《条例》相比,新版《条例》中完善了注册人制度,在医疗器械研发、生产、经营、使用整个全生命周期中,注册人都要依法承担相应的权利和义务,创新型的医疗器械将获得优先审评审批资格,以此来支持创新型产品的临床推广和使用。
新版《条例》对医疗器械的创新也有着重大意义,主要体现在以下三方面:产品上市周期缩短,研发生产成本降低,将有利于刺激中小型医疗器械企业的创新研发;实行注册人制度后,大型器械公司可结合地域、物流等各方面要素并统筹各生命周期的产业布局,优化资源配置;注册人制度实施后,产品质量低、研发管线与其他公司重合度高的中小企业将被淘汰,行业集中度将提升,有利于推动产业机构调整。
02
《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》
2021 年 6 月 4 日,国家医疗保障局、国家发展改革委、国家卫生健康委等八部门联合印发《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》,该指导意见是为了治理价格虚高问题并完善高价值医用耗材价格机制。
《意见》明确开展国家组织高值医用耗材集中带量采购和使用将重点覆盖临床用量较大、采购金额较高的产品。符合集中带量采购要求的并在采购范围内的合法资质医疗器械注册人(备案人)都可以参加。此外,所有公立医疗机构(含军队医疗机构)都应该按照规定和要求参加高值医用耗材集中采购;医保定点社会办医疗机构可以根据所在地的相关规定,根据实际情况决定是否参加集中带量采购。
《意见》还指出企业应当做好市场风险预判和防范,确保能够在采购周期内满足中选产品的采购要求。如果无法按照采购周期供应产品(除不可抗力因素),中选企业需要承担相应责任和相关的所有费用,否则将被认为是失信行为。另外,将在医保基金总额预算管理基础上,建立集中带量采购医保基金预付机制,医保基金预付比例不低于年度约定采购金额 30%,并按照采购流程进度,从医疗机构申请拨付的医疗费用中逐步冲抵预付金。
从修订后的《意见》可以发现,国家在不断改善高值医用耗材价格虚高的问题,减轻患者的经济负担,对相关高值医用耗材企业也提出了更高的要求。由于高值医用耗材的配送涉及到其他伴随服务(培训、组装等),供应难度比普通药品高,因此中选企业要做好相关的风险防范,以免出现医院库存短缺等情况。如果需要其他伴随服务,《意见》要求中选企业所供应的地区有相应的伴随服务并能够及时响应医疗机构的需求。
03
国产医疗器械采购优先相关政策
近年来,为鼓励国内医疗器械企业加强创新并增加研究开发和技术创新的投入,相关政策不断出台。2021 年,国家乃至地方层面也出台了一系列利好国产器械的相关政策。通过采购限制和提高审批/认证等要求让国产医疗器械产品充分进入市场竞争。
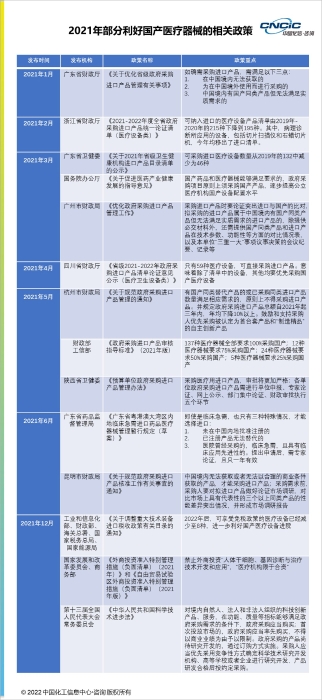
以上政策的出台将有利于推动国产医疗器械企业的创新/研发投入,缩小国产医疗器械与进口产品之间的差距。除此之外,国家还出台了一系列利好国产医疗器械的政策。(例如:优先审批国内首创且国际领先的设备;凡是符合条件的研发机构采购国产设备将全额退还增值税......)
化信观点
2021 年伴随新修订《医疗器械监督管理条例》的正式实施,一些相关的法规文件、征求意见稿、指导原则也相继发布实施。如:《医疗器械分类目录》调整、《基本医保医用耗材目录》动态调整、《禁止委托生产医疗器械目录(征求意见稿)》、《药械组合医疗器械注册审查指导原则》、《医疗器械、体外诊断试剂临床试验数据递交要求注册审查指导原则》、《医疗器械不良事件监测和再评价管理办法》......药监局数据显示,2021 年我国药监部门发布的技术指导原则和技术指南超 100 个。
随着相关政策法规体系的构建和完善,医疗器械领域治理与规范将进一步提升,各项改革措施落地也将更加有力。新的政策和条例不仅支持医疗器械的基础和应用研究,还大力推广并应用医疗器械新技术,尤其是国产产品。未来,从事医疗器械的企业需要更加重视相关条例和法规,提高质量管理和企业自身管理水平。同时,国内医疗器械企业还应当要好好把握时机,加大研发力度,努力攻克核心技术。













